Introduction
Osteomyelitis, a serious infection of bone and bone marrow, results from the invasion of bacterial, fungal, or occasionally mycobacterial pathogens, which can enter the bone through the bloodstream, from adjacent infected tissue, or by direct inoculation from trauma or surgical procedures. Without prompt and effective intervention, osteomyelitis may progress to a chronic stage, leading to extensive bone necrosis, severe disability, and, in severe cases, amputation. This guide provides a detailed, evidence-based approach to diagnosing, managing, and ensuring effective follow-up care for osteomyelitis in both pediatric and adult patients. Key focus areas include accurate diagnostic methods, targeted antimicrobial therapies, surgical interventions when necessary, and adjunctive treatments that support comprehensive recovery and minimize recurrence.
Types of Osteomyelitis
Osteomyelitis can present in acute, subacute, and chronic forms, each with distinct clinical presentations, risk factors, and treatment approaches. Recognizing the differences is essential to determine the appropriate management strategy.
- Acute Osteomyelitis:
- Onset: Develops rapidly, typically within days to a few weeks following infection. It often presents in children, especially boys, due to higher vascularity in growing bones.
- Location: Commonly affects long bones such as the femur, tibia, and humerus. In infants and children, the metaphysis (near growth plates) is most affected due to slower blood flow, allowing bacterial colonization.
- Clinical Features: Acute osteomyelitis is characterized by sudden onset of localized bone pain, swelling, redness, warmth, and fever. Systemic symptoms like malaise, irritability, and fatigue are common, and children may refuse to bear weight on or use the affected limb.
- Treatment Priority: Early diagnosis and immediate treatment with antibiotics are crucial to prevent progression to chronic osteomyelitis. Prompt surgical intervention may be needed if there is abscess formation or extensive infection.
- Subacute Osteomyelitis:
- Onset: Typically occurs within weeks to a few months after the initial infection and is less severe than acute osteomyelitis.
- Clinical Features: Symptoms are often milder, with less pain and systemic illness. Patients may have a history of a minor injury or infection.
- Diagnostic Challenge: Subacute osteomyelitis, especially Brodie’s abscess (a localized abscess within the bone), can be challenging to diagnose due to vague symptoms and lack of systemic signs.
- Treatment: Often managed with antibiotics, but surgical intervention is sometimes required, especially if there is an abscess.
- Chronic Osteomyelitis:
- Onset: Develops over months or even years, often due to unresolved or inadequately treated acute osteomyelitis or from direct infection following trauma or surgery.
- Location: Frequently seen in adults, especially those with a history of trauma, surgery, or the presence of foreign bodies, such as orthopedic hardware.
- Clinical Features: Symptoms are usually less intense than in acute cases. Patients may have persistent, dull bone pain, intermittent swelling, and draining sinus tracts. Systemic symptoms are rare, but the infection is often complicated by necrosis, bone sequestration, and involucrum (new bone formation around dead tissue).
- Treatment Complexity: Chronic osteomyelitis is challenging to treat, requiring prolonged antibiotics and often surgical debridement to remove necrotic tissue. Recurrence is common, necessitating careful long-term follow-up.
Etiology and Pathophysiology
Osteomyelitis can occur through three primary infection mechanisms, each with distinct epidemiological and clinical characteristics. Understanding these mechanisms is key to tailoring treatment and preventing recurrence.
1. Hematogenous Spread:
- Description: Occurs when pathogens in the bloodstream seed the bone, leading to infection. This is the most common cause of osteomyelitis in children and infants due to their highly vascular long bones.
- Risk Factors: Predominantly seen in young children, immunocompromised individuals, or those with bacteremia from conditions like endocarditis or urinary tract infections.
- Clinical Manifestation: Hematogenous osteomyelitis in children often affects the metaphysis of long bones like the femur and tibia, presenting with fever, pain, and swelling.
- Complications: If untreated, it can lead to abscess formation, joint involvement, and bone necrosis, which increases the risk of chronic osteomyelitis.
2. Contiguous Spread:
- Description: Osteomyelitis resulting from the spread of infection from nearby soft tissues or joints. This mechanism is more common in adults.
- Risk Factors: Frequently occurs in patients with diabetes (e.g., diabetic foot ulcers), peripheral vascular disease, or chronic wounds. Open fractures or post-operative infections also increase risk.
- Clinical Manifestation: Typically involves the bones close to the infection site, such as foot bones in diabetic ulcers or pelvis in pressure ulcers. Patients often present with localized pain, swelling, and drainage from an infected wound.
- Treatment Complexity: Contiguous spread osteomyelitis often involves polymicrobial infections, requiring broad-spectrum antibiotics and meticulous surgical debridement.
3. Direct Inoculation:
- Description: Occurs when pathogens are directly introduced into the bone during trauma, surgery, or insertion of foreign bodies such as prosthetic joints or orthopedic hardware.
- Risk Factors: Common in individuals with open fractures, penetrating injuries, or recent orthopedic surgeries, especially if aseptic techniques are compromised.
- Clinical Manifestation: Direct inoculation can lead to rapid infection, particularly if foreign bodies are present. Local symptoms, including pain and drainage from the site, are common.
- Management Challenges: Often requires hardware removal if infection persists. These cases are at a high risk for chronic osteomyelitis due to biofilm formation on foreign material, making it resistant to standard antibiotic therapy.
Pathogens
Identifying the causative pathogen is essential for effective osteomyelitis treatment. Pathogens vary depending on the patient's age, underlying conditions, and infection mechanism:
- Staphylococcus aureus:
- Overview: The primary pathogen in osteomyelitis across all age groups, accounting for the majority of cases.
- Methicillin-resistant Staphylococcus aureus (MRSA): Particularly concerning due to its resistance to standard antibiotics. MRSA infections require targeted therapy with drugs such as vancomycin or linezolid.
- Pathophysiology: Staphylococcus aureus can adhere to bone tissue and form biofilms, which protect the bacteria from immune response and antibiotics, making infections challenging to eradicate.
- Kingella kingae:
- Overview: A common pathogen in children under five, especially in hematogenous osteomyelitis.
- Clinical Presentation: Often presents with less severe symptoms than typical osteomyelitis. Kingella infections may lead to septic arthritis or subtle bone infections that require high clinical suspicion.
- Diagnostic Techniques: Standard blood cultures may not always detect Kingella kingae. PCR testing can improve detection rates.
- Salmonella:
- Overview: Notable in patients with sickle cell disease, where it frequently causes osteomyelitis.
- Pathophysiology: The bacteremia associated with sickle cell disease allows Salmonella to seed the bone, leading to infection.
- Treatment: Requires specific antibiotics, as Salmonella infections do not respond to all standard therapies used for other osteomyelitis pathogens.
- Gram-negative Organisms:
- Pseudomonas aeruginosa: Frequently found in post-traumatic osteomyelitis, especially in wounds exposed to contaminated water or soil. Pseudomonas is also common in diabetic foot infections, particularly in immunocompromised patients.
- Enterobacteriaceae (e.g., E. coli, Klebsiella): Found in polymicrobial infections, especially in patients with contiguous spread osteomyelitis associated with pressure ulcers or abdominal infections.
- Treatment Considerations: Gram-negative infections often require broad-spectrum or combination antibiotic therapy, such as ciprofloxacin or piperacillin-tazobactam, to cover a wide range of potential organisms.
- Anaerobes:
- Overview: Common in contiguous spread osteomyelitis associated with diabetic ulcers and chronic wounds.
- Pathophysiology: Anaerobic bacteria thrive in low-oxygen environments, such as necrotic tissue. They are frequently part of polymicrobial infections.
- Treatment: Requires anaerobic coverage with agents such as metronidazole or clindamycin, especially in mixed infections.
Summary of Key Points
1. Acute vs. Chronic: Understanding the differences between acute and chronic osteomyelitis is essential for early intervention. Acute cases require immediate antibiotic therapy, while chronic osteomyelitis often needs both prolonged antibiotics and surgical management.
2. Mechanism of Infection:
- Hematogenous: Common in children, typically affecting long bones.
- Contiguous: Seen in adults, especially in cases of diabetic ulcers or chronic wounds.
- Direct Inoculation: Often associated with trauma or surgery, requiring careful management to prevent biofilm formation and chronic infection.
3. Pathogen-Specific Treatment:
- Tailoring antibiotic therapy based on pathogen susceptibility is crucial for effective treatment. Empiric therapy is adjusted once culture and sensitivity results are available.
- In polymicrobial infections, combination therapy may be necessary to cover both aerobic and anaerobic organisms.
Diagnosis
Diagnosing osteomyelitis accurately and promptly is crucial to prevent progression to chronic stages and to minimize complications. A comprehensive diagnosis relies on a combination of clinical evaluation, laboratory testing, and imaging studies. This integrated approach helps identify the causative pathogen and guide an effective treatment plan.
Clinical Presentation
The clinical signs and symptoms of osteomyelitis vary by the type and duration of the infection. Differentiating between acute and chronic presentations is essential, as each type has distinct features and implications for treatment.
- Acute Osteomyelitis:
- Presents with intense, localized pain over the affected bone, accompanied by tenderness, warmth, erythema, and swelling.
- Systemic symptoms such as fever, malaise, and fatigue are common, indicating active infection.
- In pediatric cases, symptoms may be more pronounced; children may exhibit irritability, crying on movement, and refusal to bear weight or use the affected limb.
- Onset is rapid, often within days of infection, requiring prompt medical attention to prevent chronic progression.
- Chronic Osteomyelitis:
- Often develops slowly, with less pronounced systemic symptoms than acute osteomyelitis.
- Presents with persistent, dull bone pain, intermittent swelling, and in many cases, draining sinus tracts, which indicate ongoing infection with possible bone necrosis.
- Chronic osteomyelitis may follow inadequate treatment of an initial acute infection or occur after trauma or surgery.
- Systemic symptoms are generally absent, and patients may present with only mild fever or fatigue, complicating timely detection.
Laboratory Investigations
Laboratory tests play an important role in confirming osteomyelitis, identifying the infectious agent, and monitoring treatment progress.
- Inflammatory Markers (CRP, ESR):
- C-reactive protein (CRP) and erythrocyte sedimentation rate (ESR) are frequently elevated in acute osteomyelitis and serve as indicators of inflammatory response.
- In acute cases, CRP often rises more quickly than ESR, making it a useful marker for tracking early response to treatment. Serial CRP measurements can be helpful in monitoring response; a 50% reduction within one week of starting therapy generally suggests a positive response.
- In chronic osteomyelitis, elevations in CRP and ESR may be milder and less specific. Monitoring trends over time is more informative than isolated measurements.
- ESR is slower to normalize, but its gradual decline can indicate long-term response, particularly in chronic cases.
- Blood Cultures:
- Blood cultures are critical in cases of suspected hematogenous osteomyelitis, especially in children. Cultures should be collected before antibiotic initiation to maximize the likelihood of isolating the causative organism.
- Blood cultures may be positive in acute cases, providing valuable data for guiding antibiotic therapy. However, chronic cases often yield negative blood cultures due to localized infection without bacteremia.
- When blood cultures are negative or inconclusive, direct sampling through bone biopsy may be necessary.
- Bone Biopsy and Microbial Culture:
- The gold standard for osteomyelitis diagnosis, particularly in culture-negative or chronic cases where blood cultures are often inadequate.
- Bone biopsy allows for direct sampling of infected tissue, enabling precise identification of the pathogen and antimicrobial susceptibility testing.
- Biopsy is especially important in cases involving polymicrobial infections, such as diabetic foot osteomyelitis, where accurate identification of all pathogens ensures comprehensive treatment.
- Intraoperative cultures during debridement procedures can also provide essential microbiological information and aid in guiding ongoing therapy.
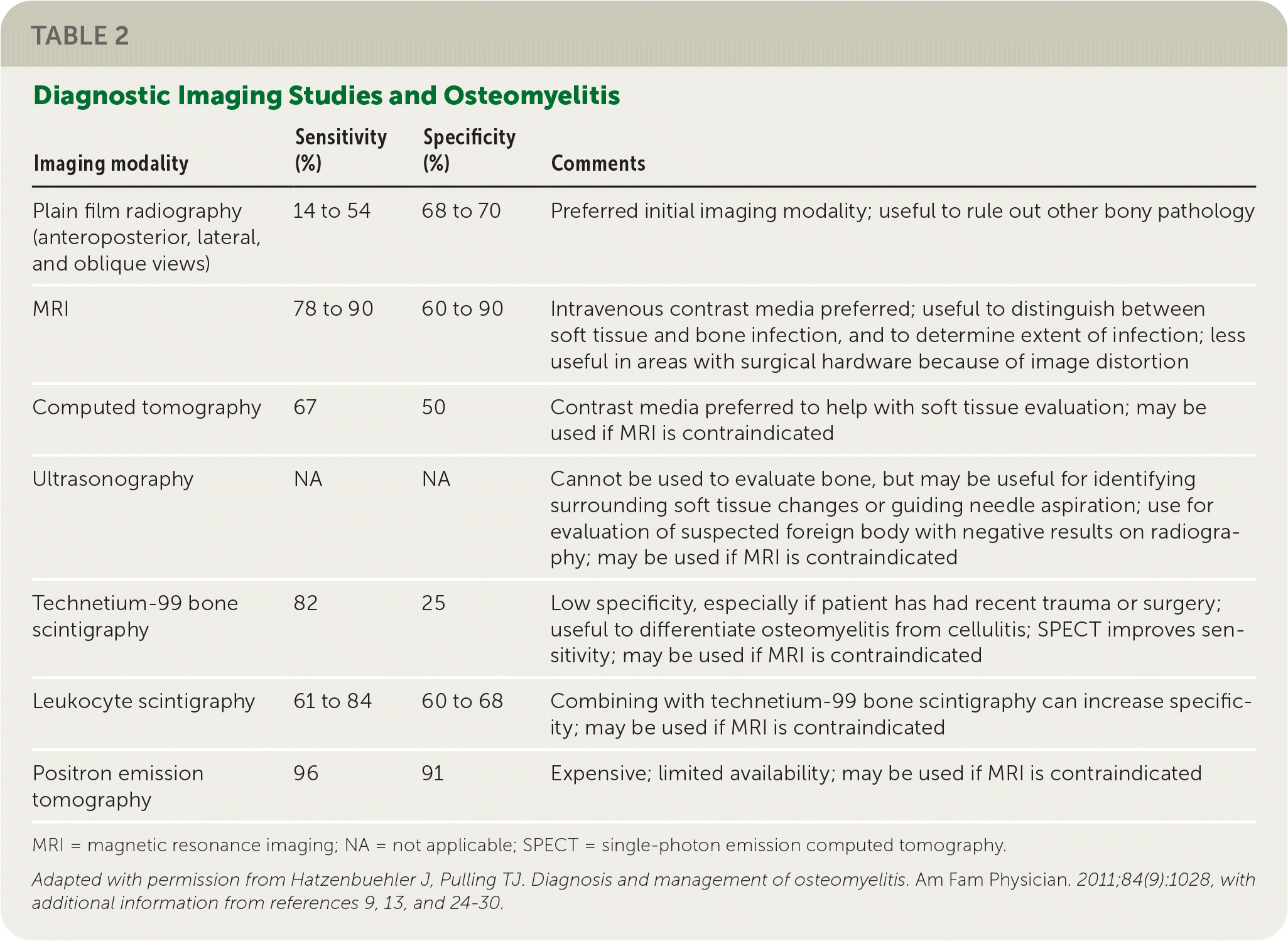
Imaging Studies
Imaging is essential for visualizing the extent of infection, detecting bone involvement, and guiding surgical planning. Each modality has unique benefits and is selected based on the stage of infection and the clinical scenario.
- MRI with Contrast:
- MRI is the preferred imaging modality for early and detailed evaluation of osteomyelitis, especially in acute cases where X-rays may appear normal.
- Contrast-enhanced MRI (gadolinium-enhanced) is highly sensitive for detecting bone marrow edema, abscesses, and periosteal reactions, which may not be evident on plain radiographs.
- MRI is also effective for assessing soft tissue involvement, helping to differentiate between osteomyelitis, cellulitis, and septic arthritis.
- In chronic osteomyelitis, MRI can help identify sequestra (isolated dead bone fragments), involucrum (new bone formation around necrotic tissue), and sinus tracts, aiding in surgical planning.
- Plain Radiographs (X-rays):
- X-rays are often the first imaging modality used, but they lack sensitivity for early-stage osteomyelitis. In acute osteomyelitis, radiographic changes may only appear after 10-14 days.
- In chronic osteomyelitis, X-rays are more informative, showing findings such as cortical destruction, sequestra, involucrum, and areas of osteosclerosis.
- Plain radiographs are especially valuable in follow-up imaging to assess structural changes in the bone and confirm healing in chronic cases.
- CT Scan:
- Computed tomography (CT) is beneficial in identifying small sequestra, cortical irregularities, and areas of bone destruction that are difficult to assess on MRI or X-ray.
- CT is particularly useful for surgical planning, especially in complex or chronic cases with extensive bone involvement.
- CT scans with contrast can also aid in identifying abscesses and planning debridement, particularly when MRI is contraindicated.
- Bone Scintigraphy (Technetium-99m Bone Scan):
- Highly sensitive for detecting increased bone activity and is particularly useful in early or multifocal osteomyelitis when MRI is unavailable or contraindicated.
- Bone scans are useful for identifying additional sites of infection in multifocal osteomyelitis, which is especially important in children or immunocompromised patients.
- Scintigraphy has limitations in distinguishing osteomyelitis from other conditions with increased bone turnover, such as fractures or arthritis, so it is best used in conjunction with other imaging modalities.
- PET/CT Scan:
- While less commonly used, PET/CT with fluorodeoxyglucose (FDG) can detect areas of high metabolic activity, which may indicate infection.
- PET/CT is particularly useful for diagnosing chronic, low-grade osteomyelitis and for identifying multifocal infection in patients who are immunocompromised or have an atypical presentation.
- Its role is expanding in cases where MRI findings are inconclusive, especially in complex or atypical infections.
Summary of Diagnostic Approach
1. Initial Evaluation:
- Perform a thorough clinical examination, focusing on localized pain, fever, swelling, and any history of trauma or recent surgery.
- Order laboratory tests (CRP, ESR, blood cultures) and obtain a baseline X-ray for initial assessment.
2. Advanced Imaging:
- If osteomyelitis is strongly suspected but X-rays are inconclusive, proceed with an MRI (with contrast if possible), especially in acute cases.
- For chronic osteomyelitis or if MRI is unavailable, consider CT for detailed bone visualization and bone scintigraphy for assessing multifocal disease.
3. Microbial Confirmation:
- In cases with positive blood cultures, adjust antibiotics accordingly.
- If blood cultures are negative and infection persists, a bone biopsy is recommended for precise microbial identification and susceptibility testing.
Management of Osteomyelitis in Adults
Effective treatment of osteomyelitis in adults requires a combination of targeted antimicrobial therapy, often accompanied by surgical intervention to eradicate the infection. The therapeutic approach should be individualized, taking into account the pathogen type, infection mechanism, patient comorbidities, and infection chronicity. Long-term treatment is necessary to prevent recurrence and to achieve complete resolution of the infection, guided by evidence-based practices.
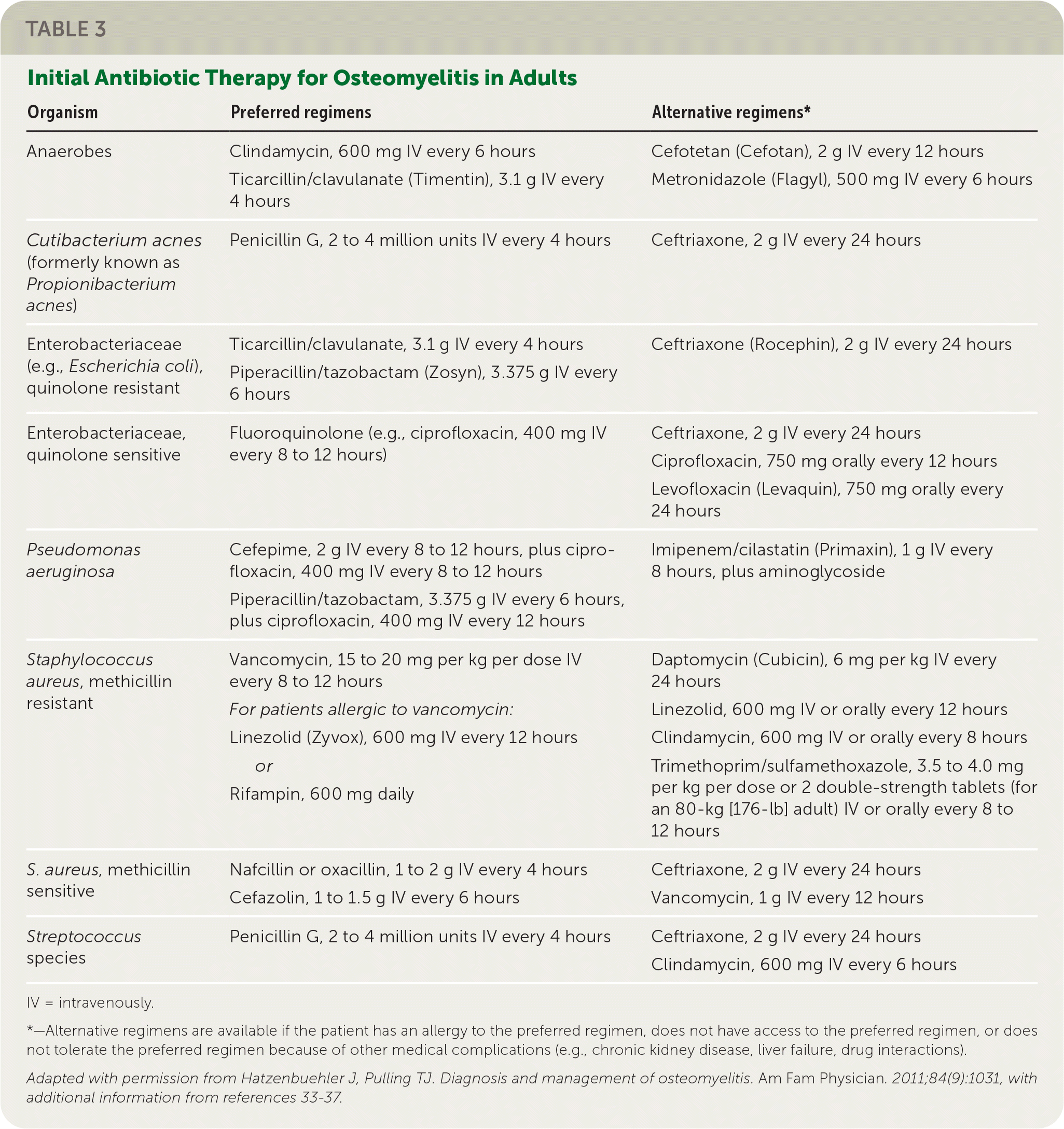
1. Empirical and Targeted Antibiotic Therapy
Initial empirical antibiotic therapy should be administered after obtaining blood and bone cultures to identify causative pathogens and determine antibiotic sensitivities. Empiric therapy is adjusted based on culture results and susceptibility patterns. The goal is to provide sustained, high-level antibiotic exposure to penetrate bone tissue effectively and eradicate infection. Evidence-based guidelines recommend 4-6 weeks of therapy, beginning with intravenous (IV) antibiotics and transitioning to oral therapy upon clinical stabilization and improvement.
Recommended Antibiotic Regimens by Pathogen Type:
- Methicillin-sensitive Staphylococcus aureus (MSSA):
- First-line therapy:
- IV Flucloxacillin: 2 g every 6 hours, preferred for its efficacy in targeting MSSA.
- Alternative for Penicillin Allergy:
- IV Cefazolin: 2 g every 8 hours or IV Clindamycin 600 mg every 8 hours.
- Oral Switch:
- After initial improvement, transition to oral Flucloxacillin 500-1000 mg every 6 hours, depending on the patient's condition.
- Duration: Total treatment duration should be 4-6 weeks, with some evidence suggesting longer therapy for severe cases or immunocompromised patients.
- Methicillin-resistant Staphylococcus aureus (MRSA):
- First-line therapy:
- IV Vancomycin: 15-20 mg/kg every 8-12 hours, with therapeutic drug monitoring (TDM) to maintain a trough level of 15-20 mg/L to ensure efficacy and reduce toxicity risks. TDM is crucial as subtherapeutic levels may contribute to treatment failure.
- Oral Switch:
- Oral Linezolid: 600 mg twice daily. Linezolid is effective for MRSA and provides good oral bioavailability.
- Duration: Typically 4-6 weeks, though cases involving extensive bone damage may require extended treatment.
- Polymicrobial Infections (e.g., Diabetic Foot Osteomyelitis):
- First-line therapy:
- IV Piperacillin-Tazobactam: 4.5 g every 6 hours, covering both gram-positive and gram-negative pathogens, including anaerobes.
- Oral Switch:
- Oral Clindamycin: 300-450 mg every 6 hours, effective for continued coverage in cases involving anaerobes or where IV therapy is impractical.
- Duration: 6-8 weeks, particularly for complex, necrotic, or treatment-resistant infections. Chronic infections may require prolonged therapy, with weekly assessments to monitor effectiveness.
Additional Considerations for Empiric Therapy Selection:
1. Broad-Spectrum Coverage: In severe or complex infections, initial broad-spectrum antibiotics may be required until culture and sensitivity results allow for de-escalation. This is especially relevant in polymicrobial or hospital-acquired infections.
2. Drug Monitoring: Regular monitoring of drug levels is recommended for medications like vancomycin to prevent toxicity and ensure therapeutic levels are maintained. This is particularly relevant for patients with renal impairment.
3. Bone Penetration: Antibiotics with high bone penetration, such as linezolid and fluoroquinolones, may be favored during the oral phase of treatment in chronic osteomyelitis.
2. Surgical Management
Surgical intervention plays an essential role, especially in chronic osteomyelitis or when antibiotics alone cannot control the infection. The surgical approach should be based on evidence-based protocols that prioritize effective debridement, minimize infection spread, and support bone healing.
Key Surgical Techniques for Osteomyelitis:
- Debridement and Sequestrectomy: Surgical debridement involves removing necrotic, infected bone and surrounding tissues to reduce bacterial load. This step is critical in chronic osteomyelitis and cases with sequestra (dead bone fragments), as infected tissues act as reservoirs for bacterial regrowth.
- Clinical Insight: Extensive debridement may create a bone defect, necessitating reconstructive procedures or bone grafting to ensure stability.
- Wound Irrigation with Antiseptics: Irrigation is performed intraoperatively with antiseptics like povidone-iodine or chlorhexidine, reducing bacterial contamination and helping prevent further spread. Evidence supports repeated irrigation in extensive or deep infections to improve local infection control.
- Irrigation Protocol: Use warmed saline followed by antiseptic solution, ideally applied through pulsatile lavage to remove biofilm and bacterial load from bone surfaces.
- Placement of Antibiotic-Impregnated Beads: For localized, high-dose antibiotic delivery, antibiotic beads (e.g., gentamicin or vancomycin-impregnated) are placed within infected bone cavities. These beads release antibiotics directly to the site, providing high local concentrations without significant systemic side effects.
- Clinical Evidence: Studies indicate improved infection control rates when antibiotic beads are used as an adjunct to systemic therapy, especially in complex or multidrug-resistant infections.
- Bone Stabilization: External fixation or internal hardware may be required for structural support, particularly in cases with significant bone loss. In nonunion cases, bone grafting or the use of osteoinductive agents like demineralized bone matrix can promote healing.
- Evidence-based Practice: External fixation is preferred in infected fields, as it reduces the risk of hardware-related infection and can be adjusted as needed during follow-up.
- Intraoperative Cultures and Sensitivity Testing: During debridement, tissue samples should be obtained for culture and sensitivity testing to guide antibiotic therapy. Swabs from sinus tracts or direct wound sampling are valuable for detecting multidrug-resistant organisms, ensuring that postoperative antibiotics are appropriately tailored.
3. Adjunctive Therapies
Adjunctive treatments play a crucial role in managing osteomyelitis, particularly in chronic cases or patients with compromised immune responses. These therapies support antibiotic and surgical interventions, providing additional means to control infection and enhance healing.
- Hyperbaric Oxygen Therapy (HBOT): HBOT can benefit patients with chronic osteomyelitis, especially those with poor vascularization or infections resistant to conventional therapy. HBOT increases oxygen delivery to the infected bone, enhancing immune cell function and promoting collagen synthesis and angiogenesis.
- Protocol: HBOT typically involves daily 90-120 minute sessions over several weeks. Evidence suggests improved outcomes in chronic osteomyelitis when used alongside antibiotics and surgical debridement.
- Nutritional Support: Proper nutrition, especially protein intake, supports wound healing and immune function. Malnutrition is a known risk factor for poor outcomes in osteomyelitis, and patients should receive dietary guidance tailored to their needs.
- Regular Monitoring and Follow-Up: Continuous monitoring is essential for assessing treatment response and detecting recurrence. Regular imaging and laboratory testing, such as weekly CRP and ESR measurements, are recommended to gauge progress.
- CRP and ESR: A 50% reduction in CRP after one week of treatment is often a favorable sign, while ESR trends help monitor long-term treatment response.
- Imaging: MRI should be repeated in cases of poor clinical response or chronic infection to confirm infection resolution.
Detailed Treatment Scheme Example
For an adult patient with MRSA-positive chronic osteomyelitis:
1. Day 1: Initiate empiric IV vancomycin at 15-20 mg/kg every 8-12 hours with TDM.
2. Day 2-5: Surgical debridement with intraoperative cultures, wound irrigation with povidone-iodine, placement of antibiotic beads, and external fixation for stability.
3. Week 1: Reassess CRP and ESR; adjust vancomycin dosing based on TDM results.
4. Week 2: Assess culture results and modify antibiotics as needed, consider adding oral Linezolid if switching to oral therapy.
5. Weeks 2-6: Continue IV vancomycin; monitor weekly CRP/ESR and adjust therapy based on clinical and lab findings.
6. Week 6: Transition to oral Linezolid if infection is controlled and patient clinically stable.
7. Follow-Up: Monthly imaging and lab tests for six months post-treatment, with MRI if symptoms recur.
Management of Osteomyelitis in Children
Pediatric osteomyelitis, often presenting as acute hematogenous osteomyelitis, primarily affects the long bones, such as the femur, tibia, and humerus. Due to the unique characteristics of the pediatric skeleton, prompt and effective treatment is critical to prevent growth disturbances, joint deformities, and other long-term complications. The treatment of osteomyelitis in children relies on targeted antimicrobial therapy, close monitoring, and, in select cases, surgical intervention. Evidence-based protocols emphasize early and aggressive treatment to achieve optimal outcomes.
1. Empirical and Targeted Antibiotic Therapy
Immediate initiation of intravenous (IV) antibiotics is essential in suspected cases of pediatric osteomyelitis, especially in children presenting with systemic signs of infection, such as fever, irritability, or limited use of the affected limb. Empirical antibiotics are chosen based on the most likely pathogens, with adjustments made according to culture and sensitivity results. Duration of therapy is generally shorter than in adults, but close monitoring remains crucial for assessing response to treatment and guiding adjustments.
Key Antibiotic Regimens by Age and Pathogen Susceptibility:
- Children >5 Years (Likely Methicillin-sensitive Staphylococcus aureus [MSSA]):
- IV Flucloxacillin: 50 mg/kg every 6 hours (up to a maximum of 2 g per dose), preferred for its high efficacy against MSSA and its favorable safety profile in children.
- Oral Switch: Once clinical improvement is noted, transition to oral Flucloxacillin 25-50 mg/kg every 6 hours. The dosage should be adjusted according to weight and severity of infection.
- Duration: Typically 3-4 weeks in total, with at least 1-2 weeks of IV therapy, followed by oral antibiotics until full resolution.
- Children <5 Years (Risk of Kingella kingae):
- IV Cefazolin: 50 mg/kg every 8 hours (maximum 2 g per dose). Cefazolin is preferred due to its effectiveness against Kingella kingae, a common cause in young children, particularly in hematogenous osteomyelitis cases.
- Oral Switch: Transition to oral Cephalexin 30 mg/kg every 8 hours once improvement is noted.
- Duration: 3-4 weeks, depending on response, with at least 7-10 days of IV therapy.
- MRSA (Methicillin-resistant Staphylococcus aureus):
- IV Vancomycin: 15 mg/kg every 6 hours (maximum 750 mg per dose) with therapeutic drug monitoring (TDM) to maintain optimal trough levels between 15-20 mg/L, essential for ensuring efficacy and minimizing toxicity.
- Oral Switch: Oral Clindamycin 10 mg/kg every 6 hours. Clindamycin provides effective coverage for MRSA and has good bone penetration.
- Duration: Generally 4-6 weeks, with a longer duration in cases of extensive infection or slow response.
Additional Considerations for Antibiotic Therapy in Children:
1. Therapeutic Drug Monitoring (TDM): For vancomycin, TDM is crucial, particularly in young children, to avoid nephrotoxicity and ensure therapeutic levels.
2. Adjunctive Therapy: If patients fail to respond to first-line therapy, consider adjunctive therapy with linezolid or daptomycin, especially in cases of resistant pathogens. Linezolid is beneficial due to its excellent bioavailability and bone penetration, although prolonged use should be limited to avoid hematologic side effects.
2. Surgical Management
While antibiotic therapy is the mainstay for treating osteomyelitis in children, surgical intervention may be necessary when there is inadequate response to antibiotics, as indicated by persistent symptoms, rising inflammatory markers, or imaging evidence of abscess formation, necrotic bone, or joint involvement. Surgical management is carefully tailored to minimize potential impact on growth plates and joint function.
Key Surgical Interventions for Pediatric Osteomyelitis:
- Abscess Drainage and Debridement: For children with imaging evidence of abscess formation or necrotic bone, early surgical drainage or debridement is necessary. Drainage reduces bacterial load, alleviates pressure, and enhances the effectiveness of systemic antibiotics. In cases where imaging shows multiple abscesses, needle aspiration under ultrasound or MRI guidance can provide targeted intervention without extensive surgical exposure.
- Bone Curettage: When sequestra (dead bone fragments) are present, curettage can help remove infected and necrotic tissue, reducing the bacterial burden and promoting healing. Care must be taken to avoid damaging the growth plate in pediatric patients, as this could lead to long-term skeletal deformities.
- Wound Irrigation: Intraoperative irrigation with saline, povidone-iodine, or other antiseptic solutions helps control local bacterial load and minimizes infection spread. In cases of extensive infection, repeated irrigation with pulsatile lavage may be required to disrupt biofilms and reduce bacterial colonization.
- Sampling for Cultures and Sensitivity Testing: During surgical intervention, it is essential to obtain tissue samples or swabs for culture and sensitivity testing. These samples guide antibiotic adjustments, especially in chronic or recurrent infections, by identifying resistant organisms and ensuring that antibiotic therapy remains targeted and effective.
3. Adjunctive and Supportive Therapies
Adjunctive therapies play a supportive role in managing pediatric osteomyelitis, particularly in chronic or recurrent cases where conventional therapy alone may be insufficient. They help promote healing, enhance antibiotic efficacy, and support overall recovery.
- Immobilization of Affected Limb: Immobilization with splints or braces may be recommended during the initial phase of treatment to relieve pain, minimize movement, and prevent further spread of infection. Immobilization also promotes adherence to rest, which is essential for recovery in pediatric patients.
- Nutritional Support: Good nutritional status is important for optimal immune function and bone healing. Children with osteomyelitis may require increased protein intake to support healing, along with adequate vitamins and minerals such as vitamin D and calcium, which are essential for bone health.
- Regular Monitoring and Follow-Up: Monitoring inflammatory markers such as C-reactive protein (CRP) and erythrocyte sedimentation rate (ESR) is essential throughout treatment to gauge response. Pediatric patients should have weekly assessments during the active treatment phase, and monthly follow-ups thereafter until the infection is confirmed as resolved.
- CRP and ESR Trends: A reduction in CRP by at least 50% within the first week is a favorable indicator of treatment efficacy. ESR, while slower to respond, can provide a long-term marker of infection resolution.
- Follow-up Imaging: MRI is recommended in cases with poor clinical response or where residual infection is suspected. Follow-up imaging can detect persistent bone involvement, ensuring early intervention if needed.
- Hyperbaric Oxygen Therapy (HBOT): In cases of chronic or treatment-resistant osteomyelitis, HBOT may be beneficial. Increased oxygenation supports immune function, enhances antibiotic activity, and promotes healing. Evidence supports its use in refractory osteomyelitis, particularly in children with compromised blood supply to the infected area.
Detailed Treatment Scheme Example for Pediatric Osteomyelitis (Hematogenous, MSSA Positive):
1. Day 1-7: Start IV Flucloxacillin 50 mg/kg every 6 hours (maximum 2 g per dose) based on suspected MSSA. Obtain blood and bone cultures.
2. Day 2-5: Assess clinical response with daily evaluations of symptoms, limb use, and pain levels. Monitor CRP and ESR levels.
3. Day 7: Evaluate culture results to confirm MSSA. Adjust antibiotics if necessary based on sensitivity. Transition to oral Flucloxacillin if the patient is stable and symptoms are improving.
4. Weeks 2-4: Continue oral Flucloxacillin 25-50 mg/kg every 6 hours. Assess weekly CRP and ESR; evaluate for symptoms such as fever, limb pain, or limited use.
5. Follow-Up Imaging: MRI or ultrasound may be repeated if symptoms persist or inflammatory markers remain elevated beyond Week 4.
6. Completion of Therapy: Discontinue antibiotics if the child remains asymptomatic with normalized CRP and ESR.
Monitoring and Follow-up
Effective management of osteomyelitis requires diligent monitoring to assess treatment response, confirm infection resolution, and prevent recurrence. Pediatric patients, in particular, benefit from regular follow-up due to the potential impact on growth plates and the risk of skeletal deformities.
- CRP and ESR Monitoring:
C-reactive protein (CRP) and erythrocyte sedimentation rate (ESR) are essential markers for tracking inflammation and infection. In acute osteomyelitis, these markers typically elevate during infection and decrease as the infection resolves. A 50% or greater reduction in CRP within the first week of treatment generally suggests a favorable response. ESR, which changes more slowly, provides a long-term indicator of inflammatory activity and can help in assessing chronic or residual infection.
- Imaging Follow-up:
MRI is the preferred modality for assessing treatment response and detecting residual or recurrent infection, particularly in chronic cases or when clinical improvement is inadequate. Repeat MRI may be scheduled at key points during and after treatment, especially if the patient shows persistent symptoms or elevated inflammatory markers. MRI can reveal ongoing bone involvement, abscesses, or subtle changes in bone marrow, ensuring early detection and timely intervention.
- Long-term Pediatric Follow-up:
In children, osteomyelitis can impact the growth plates, posing a risk of growth abnormalities or deformities if not effectively managed. Children with infections involving or near growth plates require follow-up until they reach skeletal maturity. Regular clinical assessments and imaging allow for early identification of potential growth disturbances, enabling timely orthopedic interventions if abnormalities arise. Monitoring includes assessing limb length, joint alignment, and function during growth.
- Scheduled Follow-Up Visits:
- 1 Week Post-Treatment Initiation: Check CRP, ESR, and clinical symptoms. Review the need for adjustments based on early response.
- End of IV Therapy: Confirm clinical improvement before transitioning to oral antibiotics.
- 1 Month After Completion of Therapy: Re-evaluate CRP, ESR, and any residual symptoms; MRI if indicated.
- 3-6 Months After Treatment: For chronic or growth plate involvement, conduct follow-up imaging and clinical assessment. Long-term follow-ups every 6-12 months may be needed for pediatric patients with growth plate infections.
Conclusion
Managing osteomyelitis requires a well-coordinated, interdisciplinary approach involving orthopedic surgeons, infectious disease specialists, radiologists, and, when necessary, pediatricians or rehabilitation experts. Key components for success include early, accurate diagnosis, prompt initiation of pathogen-targeted antibiotics, and, when indicated, timely surgical debridement to remove necrotic tissue and prevent the spread of infection.
Implementing evidence-based treatment protocols and maintaining rigorous follow-up are essential to achieve the best possible outcomes. By closely monitoring treatment response through clinical assessments, laboratory markers, and imaging, healthcare providers can reduce the risk of chronic infection, minimize complications, and address potential relapses proactively.
For pediatric patients, continued follow-up until skeletal maturity ensures that growth plate involvement is detected early, allowing for timely intervention to prevent deformities. With diligent care and a commitment to evidence-based practices, both adults and children with osteomyelitis have a strong potential for full recovery and a low risk of recurrence, underscoring the importance of a comprehensive and collaborative treatment approach.
References
Prepared by:
Dr. Vasyl M. Shlemko, Orthopedic Surgeon
🇺🇦 Українською мовою:
Остеомієліт: посібник з діагностики, антибіотикотерапії та хірургічного лікування
Вступ
Остеомієліт — це серйозне запалення кістки та кісткового мозку, викликане інвазією бактеріями, грибками або рідше мікобактеріями, що можуть потрапити в кістку через кровоток, із сусідніх інфікованих тканин або через пряме інокулювання внаслідок травм чи оперативних втручань. За відсутності швидкого та ефективного лікування, остеомієліт може перейти у хронічну стадію, призводячи до значного некрозу кісткової тканини, важких ускладнень та, в крайніх випадках, до ампутації. Цей посібник надає детальний, заснований на доказах підхід до діагностики, лікування та забезпечення ефективного подальшого догляду за пацієнтами з остеомієлітом у дитячому та дорослому віці. Ключовими аспектами є точні методи діагностики, цілеспрямована антимікробна терапія, необхідні хірургічні втручання та допоміжні методи, які сприяють комплексному одужанню та мінімізують ризик рецидивів.
Типи остеомієліту
Остеомієліт може проявлятися в гострій, підгострій та хронічній формах, кожна з яких має відмінні клінічні ознаки, фактори ризику та підходи до лікування. Розпізнавання відмінностей важливе для визначення відповідної стратегії лікування.
- Гострий остеомієліт:
- Початок: Розвивається швидко, зазвичай протягом кількох днів або тижнів після інфікування. Часто зустрічається у дітей, особливо у хлопчиків, через більшу васкулярність ростучих кісток.
- Локалізація: Найчастіше уражає довгі кістки, такі як стегнова, великогомілкова та плечова. У немовлят і дітей найбільш ураженою є метафіза, оскільки в ній сповільнений кровообіг, що сприяє колонізації бактерій.
- Клінічні ознаки: Гострий остеомієліт характеризується раптовим виникненням локалізованого болю в кістці, набряком, почервонінням, теплом та лихоманкою. Часто спостерігаються системні симптоми, такі як загальне нездужання, дратівливість і втома, діти можуть відмовлятися від навантаження або використання ураженої кінцівки.
- Пріоритет лікування: Своєчасна діагностика та негайне лікування антибіотиками є важливими для запобігання переходу до хронічного остеомієліту. За наявності абсцесу або значного інфікування може знадобитися негайне хірургічне втручання.
- Підгострий остеомієліт:
- Початок: Зазвичай розвивається протягом кількох тижнів або місяців після початкового інфікування і менш серйозний, ніж гострий остеомієліт.
- Клінічні ознаки: Симптоми часто менш виражені, з меншою болісністю та загальним нездужанням. Пацієнти можуть мати в анамнезі незначну травму або інфекцію.
- Діагностична складність: Підгострий остеомієліт, особливо абсцес Броді (локалізований абсцес у кістці), може бути складним для діагностики через розмиті симптоми та відсутність системних ознак.
- Лікування: Часто лікується антибіотиками, але іноді потрібне хірургічне втручання, особливо за наявності абсцесу.
- Хронічний остеомієліт:
- Початок: Розвивається протягом місяців або навіть років, часто внаслідок невирішеного або неадекватно пролікованого гострого остеомієліту або прямого інфікування після травми або операції.
- Локалізація: Часто зустрічається у дорослих, особливо у тих, хто має в анамнезі травми, операції або наявність сторонніх тіл, таких як ортопедичне устаткування.
- Клінічні ознаки: Симптоми зазвичай менш виражені, ніж у гострих випадках. Пацієнти можуть відчувати постійний тупий біль у кістці, періодичні набряки та утворення гнійних свищів. Системні симптоми рідкісні, але інфекція часто ускладнюється некрозом, секвестрами (мертва тканина кістки) та формуванням інволюкруму (нова кісткова тканина навколо ураженої ділянки).
- Складність лікування: Лікування хронічного остеомієліту вимагає тривалої антибіотикотерапії та часто хірургічного видалення некротизованих тканин. Рецидиви трапляються досить часто, тому потрібне ретельне довгострокове спостереження.
Етіологія та патофізіологія
Остеомієліт може виникати через три основні механізми інфікування, кожен із яких має свої епідеміологічні та клінічні характеристики. Розуміння цих механізмів є ключовим для адаптації лікування та запобігання рецидиву.
1. Гематогенне поширення:
- Опис: Виникає, коли патогени потрапляють у кровотік і осідають у кістковій тканині, що призводить до інфікування. Це найпоширеніша причина остеомієліту у дітей та немовлят через високу васкуляризацію довгих кісток.
- Фактори ризику: Найчастіше спостерігається у молодих дітей, ослаблених осіб або пацієнтів із бактеріємією, викликаною такими станами, як ендокардит або інфекції сечових шляхів.
- Клінічні прояви: Гематогенний остеомієліт у дітей часто вражає метафіз довгих кісток, таких як стегнова та великогомілкова, і супроводжується лихоманкою, болем та набряком.
- Ускладнення: Якщо залишити без лікування, може призвести до утворення абсцесу, залучення суглобів і некрозу кісток, що підвищує ризик хронічного остеомієліту.
2. Контактне поширення:
- Опис: Остеомієліт, що виникає внаслідок поширення інфекції з прилеглих м'яких тканин або суглобів, є більш поширеним у дорослих.
- Фактори ризику: Часто зустрічається у пацієнтів із діабетом (наприклад, при діабетичній стопі), периферичними судинними захворюваннями або хронічними ранами. Також ризик підвищується за наявності відкритих переломів або післяопераційних інфекцій.
- Клінічні прояви: Зазвичай охоплює кістки, близькі до місця інфекції, такі як кістки стопи при діабетичній стопі або таз при пролежнях. Пацієнти часто відчувають локальний біль, набряк і виділення з інфікованої рани.
- Складність лікування: Контактний остеомієліт часто супроводжується полімікробними інфекціями, що потребує широкого спектра антибіотиків та ретельного хірургічного очищення.
3. Пряме інокулювання:
- Опис: Виникає, коли патогени безпосередньо потрапляють у кістку під час травми, хірургічного втручання або встановлення сторонніх тіл, таких як протези суглобів або ортопедичне обладнання.
- Фактори ризику: Зустрічається у пацієнтів з відкритими переломами, проникними травмами або після ортопедичних операцій, особливо за недотримання асептичних правил.
- Клінічні прояви: Пряме інокулювання може швидко спричинити інфекцію, особливо якщо є сторонні тіла. Часто виникає локальний біль та виділення з місця інокулювання.
- Складнощі управління: Часто вимагає видалення апаратури у випадках, коли інфекція зберігається. Такі випадки мають високий ризик хронічного остеомієліту через утворення біоплівки на сторонньому матеріалі, що робить її стійкою до стандартної антибіотикотерапії.
Патогени
Виявлення збудника є критично важливим для ефективного лікування остеомієліту. Патогени варіюються залежно від віку пацієнта, основних захворювань та механізму інфекції:
- Staphylococcus aureus:
- Огляд: Основний патоген остеомієліту у всіх вікових групах, що становить більшість випадків.
- Метицилін-резистентний Staphylococcus aureus (MRSA): Викликає особливу стурбованість через стійкість до стандартних антибіотиків. Інфекції MRSA потребують цілеспрямованої терапії з використанням препаратів, таких як ванкоміцин або лінезолід.
- Патофізіологія: Staphylococcus aureus може прикріплюватися до кісткової тканини та утворювати біоплівки, що захищають бактерії від імунної відповіді та антибіотиків, що ускладнює ерадикацію інфекцій.
- Kingella kingae:
- Огляд: Зустрічається серед дітей до п’яти років, особливо при гематогенному остеомієліті.
- Клінічні прояви: Зазвичай супроводжується менш вираженими симптомами порівняно з типовим остеомієлітом. Інфекції Kingella можуть спричиняти септичний артрит або приховані інфекції кісток, що вимагають високого клінічного підозрення.
- Діагностичні методи: Стандартні посіви крові можуть не завжди виявляти Kingella kingae. Полімеразно-ланцюгова реакція (ПЛР) може покращити рівень виявлення.
- Salmonella:
- Огляд: Відзначається серед пацієнтів із серповидноклітинною анемією, де часто спричиняє остеомієліт.
- Патофізіологія: Бактеріємія, що пов’язана із серповидноклітинною анемією, дозволяє Salmonella потрапити в кісткову тканину, викликаючи інфекцію.
- Лікування: Вимагає специфічних антибіотиків, оскільки інфекції Salmonella не реагують на всі стандартні препарати, що застосовуються для інших збудників остеомієліту.
- Грамнегативні організми:
- Pseudomonas aeruginosa: Часто виявляється при посттравматичному остеомієліті, особливо в ранах, що піддавалися впливу забрудненої води або ґрунту. Pseudomonas також поширена серед діабетичних інфекцій стопи, особливо у пацієнтів з ослабленим імунітетом.
- Enterobacteriaceae (наприклад, E. coli, Klebsiella): Зустрічаються в полімікробних інфекціях, особливо у пацієнтів з контактним остеомієлітом, пов’язаним з пролежнями або інфекціями черевної порожнини.
- Міркування щодо лікування: Інфекції, викликані грамнегативними організмами, часто вимагають антибіотикотерапії широкого спектра дії або комбінації препаратів, таких як ципрофлоксацин або піперацилін-тазобактам, для охоплення широкого спектра потенційних збудників.
- Анаероби:
- Огляд: Поширені при остеомієліті, пов’язаному з діабетичними виразками та хронічними ранами.
- Патофізіологія: Анаеробні бактерії розмножуються в умовах низького вмісту кисню, таких як некротична тканина. Вони часто є частиною полімікробних інфекцій.
- Лікування: Вимагає охоплення анаеробів з використанням препаратів, таких як метронідазол або кліндаміцин, особливо при змішаних інфекціях.
Короткий огляд ключових моментів
1. Гострий та хронічний остеомієліт: Розуміння відмінностей між гострим та хронічним остеомієлітом є критичним для раннього втручання. Гострі випадки потребують негайної антибіотикотерапії, тоді як хронічний остеомієліт часто вимагає як тривалої антибіотикотерапії, так і хірургічного лікування.
2. Механізм інфікування:
- Гематогенне поширення: Поширене у дітей, зазвичай уражає довгі кістки.
- Контактне поширення: Спостерігається у дорослих, особливо у випадках діабетичних виразок або хронічних ран.
- Пряме інокулювання: Часто пов’язане з травмами або хірургічним втручанням, що вимагає ретельного управління для запобігання утворенню біоплівок та хронічному інфікуванню.
3. Цілеспрямоване лікування збудника:
- Вибір антибіотиків, орієнтований на чутливість патогену, є ключовим для ефективного лікування. Емпірична терапія коригується після отримання результатів посіву та чутливості.
- У випадках полімікробних інфекцій може знадобитися комбінована терапія для покриття як аеробних, так і анаеробних організмів.
Діагностика
Точна та своєчасна діагностика остеомієліту є критичною для запобігання прогресу до хронічної стадії та мінімізації ускладнень. Комплексний підхід до діагностики ґрунтується на клінічному обстеженні, лабораторних тестах та візуалізаційних дослідженнях, що допомагає точно визначити збудника та розробити ефективний план лікування.
Клінічні прояви
Клінічні ознаки та симптоми остеомієліту змінюються залежно від типу та тривалості інфекції. Розрізнення гострого та хронічного перебігу має вирішальне значення, оскільки кожен тип має свої особливості та впливає на підхід до лікування.
- Гострий остеомієліт:
- Характеризується інтенсивним локалізованим болем ураженої кістки, а також болючістю, теплотою, почервонінням та набряком.
- Системні симптоми, такі як лихоманка, загальне нездужання та втома, свідчать про активну інфекцію.
- У дітей симптоми можуть бути вираженішими; вони можуть демонструвати дратівливість, плач під час руху та відмову від навантаження на уражену кінцівку.
- Швидкий початок, зазвичай протягом кількох днів після інфікування, вимагає невідкладної медичної допомоги для запобігання хронізації.
- Хронічний остеомієліт:
- Розвивається поступово, зі значно менш вираженими системними симптомами, ніж гострий остеомієліт.
- Характеризується стійким, тупим болем у кістці, періодичним набряком і наявністю свищевих ходів, що вказують на триваючу інфекцію та можливий некроз кістки.
- Може виникати внаслідок недостатнього лікування первинної гострої інфекції або після травми чи операції.
- Системні симптоми, як правило, відсутні, і пацієнти можуть мати лише незначну лихоманку або втому, що ускладнює своєчасне виявлення.
Лабораторні дослідження
Лабораторні тести відіграють важливу роль у підтвердженні остеомієліту, ідентифікації збудника та моніторингу прогресу лікування.
- Маркер запалення (СРБ, ШОЕ):
- С-реактивний білок (СРБ) і швидкість осідання еритроцитів (ШОЕ) зазвичай підвищені при гострому остеомієліті та є індикаторами запальної відповіді.
- У гострих випадках СРБ часто підвищується швидше, ніж ШОЕ, що робить його корисним маркером для раннього відстеження відповіді на лікування. Серійні вимірювання СРБ можуть бути корисними для моніторингу відповіді; зниження на 50% протягом тижня після початку терапії зазвичай свідчить про позитивний ефект.
- При хронічному остеомієліті підвищення СРБ і ШОЕ може бути менш вираженим і менш специфічним. Моніторинг тенденцій у часі є більш інформативним, ніж окремі вимірювання.
- ШОЕ знижується повільніше, але його поступове зниження може свідчити про довгострокову відповідь, особливо при хронічних випадках.
- Посіви крові:
- Посіви крові є критично важливими у випадках підозри на гематогенний остеомієліт, особливо у дітей. Їх слід брати до початку антибіотикотерапії, щоб максимізувати ймовірність виявлення збудника.
- Посіви крові можуть бути позитивними при гострих випадках, що надає цінну інформацію для вибору антибіотиків. Однак у хронічних випадках посіви крові часто дають негативний результат через локалізовану інфекцію без бактеріємії.
- Якщо посіви крові негативні або непереконливі, може знадобитися пряма біопсія кістки.
- Біопсія кістки та мікробіологічний посів:
- Золотий стандарт для діагностики остеомієліту, особливо у випадках із негативними результатами посівів крові або при хронічних інфекціях, де посіви крові часто є недостатніми.
- Біопсія кістки дозволяє безпосередньо отримати зразки інфікованих тканин, що дозволяє точно ідентифікувати збудника та визначити його чутливість до антибіотиків.
- Біопсія є особливо важливою у випадках полімікробних інфекцій, таких як остеомієліт при діабетичній стопі, де точне виявлення всіх патогенів забезпечує повне лікування.
- Інтраопераційні культури під час хірургічного очищення також можуть надати важливу мікробіологічну інформацію для коригування терапії.
Візуалізаційні дослідження
Візуалізація є важливою для виявлення ступеня інфекції, оцінки ураження кістки та планування хірургічного втручання. Кожна методика має унікальні переваги і вибирається залежно від стадії інфекції та клінічного сценарію.
МРТ з контрастом:
- МРТ є переважним методом візуалізації для ранньої та детальної оцінки остеомієліту, особливо при гострих випадках, коли рентгенографія може бути нормальною.
- Контрастне МРТ (з використанням гадолінію) є високочутливим для виявлення набряку кісткового мозку, абсцесів та реакцій окістя, які можуть бути не помітні на звичайних рентгенограмах.
- МРТ також ефективний для оцінки ураження м'яких тканин, допомагаючи диференціювати остеомієліт, целюліт та септичний артрит.
- При хронічному остеомієліті МРТ допомагає виявляти секвестри (ізольовані ділянки мертвої кістки), інволюкрум (нова кістка, що утворюється навколо некротичної тканини) та свищеві ходи, що полегшує планування операції.
Звичайна рентґенографія (пулюївське проміння):
- Рентґенографія часто є першим методом візуалізації, але вона має низьку чутливість для ранніх стадій остеомієліту. У гострому остеомієліті рентґенографічні зміни можуть бути помітні лише через 10-14 днів.
- У хронічному остеомієліті рентґенографія більш інформативна, показуючи такі зміни, як руйнування кіркової кістки, секвестри, інволюкрум і ділянки остеосклерозу.
- Звичайні рентґенограми є особливо цінними для візуалізації змін структури кістки та підтвердження загоєння у хронічних випадках.
КТ:
- Комп'ютерна томографія (КТ) корисна для виявлення невеликих секвестрів, нерівностей кіркової кістки та ділянок руйнування кістки, які важко оцінити на МРТ або рентґенографії.
- КТ особливо корисна для планування хірургічного втручання, особливо при складних або хронічних випадках з великим ураженням кістки.
- КТ із контрастом також може допомогти виявити абсцеси та планувати очищення, особливо коли МРТ протипоказане.
- Сцинтиграфія кісток (технецій-99m):
- Сцинтиграфія має високу чутливість до виявлення підвищеної активності в кістці та є особливо корисною на ранніх стадіях або при мультифокальному остеомієліті, коли МРТ недоступне або протипоказане.
- Сцинтиграфія корисна для виявлення додаткових ділянок інфекції при мультифокальному остеомієліті, що є особливо важливим у дітей або імунокомпрометованих пацієнтів.
- Сцинтиграфія має обмеження у розрізненні остеомієліту від інших станів з підвищеним обміном у кістці, таких як переломи або артрити, тому її краще використовувати разом з іншими методами візуалізації.
ПЕТ-КТ:
- Хоча використовується рідше, ПЕТ-КТ із фтордезоксиглюкозою (ФДГ) може виявляти ділянки з високою метаболічною активністю, що може вказувати на інфекцію.
- ПЕТ-КТ особливо корисний для діагностики хронічного, маловираженого остеомієліту та для виявлення мультифокальних інфекцій у пацієнтів із імунодефіцитом або атиповою клінічною картиною.
- Його роль розширюється у випадках, коли результати МРТ непереконливі, особливо при складних або атипових інфекціях.
Резюме підходу до діагностики
1. Первинна оцінка:
- Виконайте ретельний клінічний огляд, звертаючи увагу на локалізований біль, лихоманку, набряк та будь-яку історію травми або нещодавньої операції.
- Замовте лабораторні тести (СРБ, ШОЕ, посіви крові) та отримайте базову рентгенографію для початкової оцінки.
2. Розширена візуалізація:
- Якщо остеомієліт є дуже ймовірним, але рентґенограми непереконливі, виконуйте МРТ (по можливості з контрастом), особливо при гострих випадках.
- Для хронічного остеомієліту або коли МРТ недоступне, розгляньте можливість використання КТ для детальної візуалізації кістки та сцинтиграфії кісток для оцінки мультифокального ураження.
3. Мікробіологічне підтвердження:
- У випадках з позитивними посівами крові коригуйте антибіотикотерапію відповідно до результатів.
- Якщо посіви крові негативні та інфекція зберігається, рекомендується біопсія кістки для точної ідентифікації збудника та тестування чутливості.
Лікування остеомієліту у дорослих
Ефективне лікування остеомієліту у дорослих вимагає поєднання таргетної антимікробної терапії, часто у супроводі хірургічного втручання для ліквідації інфекції. Лікувальний підхід повинен бути індивідуалізованим з урахуванням типу збудника, механізму інфікування, супутніх захворювань пацієнта та хронічності інфекції. Довготривале лікування є необхідним для запобігання рецидиву та досягнення повної ліквідації інфекції, з використанням доказових практик.
1. Емпірична та таргетна антибіотикотерапія
Початкову емпіричну антибіотикотерапію слід розпочати після отримання посівів крові та кістки для визначення збудника та його чутливості до антибіотиків. Емпіричну терапію коригують на основі результатів посівів і чутливості. Мета полягає у забезпеченні тривалої, високої експозиції антибіотиків для ефективного проникнення в кісткову тканину та ліквідації інфекції. Доказові рекомендації передбачають 4-6 тижнів терапії, починаючи з внутрішньовенних (в/в) антибіотиків з подальшим переходом на пероральну терапію після стабілізації та клінічного поліпшення.
Рекомендовані антибіотики за типом збудника:
- Метицилін-чутливий Staphylococcus aureus (MSSA):
- Терапія першої лінії:
- IV флуклоксацилін: 2 г кожні 6 годин, рекомендований через його ефективність проти MSSA.
- Альтернатива для алергії на пеніцилін:
- IV цефазолін: 2 г кожні 8 годин або IV кліндаміцин 600 мг кожні 8 годин.
- Перехід на пероральне лікування:
- Після початкового поліпшення перехід на пероральний флуклоксацилін 500-1000 мг кожні 6 годин, залежно від стану пацієнта.
- Тривалість: Загальна тривалість лікування повинна становити 4-6 тижнів, з деякими доказами на користь більш тривалої терапії у важких випадках або у пацієнтів з імунодефіцитом.
- Метицилін-резистентний Staphylococcus aureus (MRSA):
- Терапія першої лінії:
- IV ванкоміцин: 15-20 мг/кг кожні 8-12 годин з терапевтичним моніторингом рівнів препарату для досягнення концентрації 15-20 мг/л у trough для забезпечення ефективності та зменшення ризику токсичності.
- Перехід на пероральне лікування:
- Пероральний лінезолід: 600 мг двічі на день. Лінезолід ефективний для лікування MRSA та забезпечує хорошу біодоступність при пероральному прийомі.
- Тривалість: Зазвичай 4-6 тижнів, однак випадки з великою пошкодженою ділянкою кістки можуть потребувати продовженого лікування.
- Полімікробні інфекції (наприклад, остеомієліт стопи при діабеті):
- Терапія першої лінії:
- IV піперацилін-тазобактам: 4,5 г кожні 6 годин для охоплення як грампозитивних, так і грамнегативних збудників, включаючи анаероби.
- Перехід на пероральне лікування:
- Пероральний кліндаміцин: 300-450 мг кожні 6 годин, ефективний для тривалої терапії у випадках з анаеробними збудниками або коли в/в терапія не є практичною.
- Тривалість: 6-8 тижнів, особливо для складних, некротичних або стійких до лікування інфекцій. Хронічні інфекції можуть вимагати тривалої терапії з щотижневими оцінками для моніторингу ефективності.
2. Хірургічне лікування
Хірургічне втручання відіграє важливу роль, особливо при хронічному остеомієліті або коли антибіотикотерапія не забезпечує контролю над інфекцією. Хірургічний підхід повинен базуватися на доказових протоколах, що забезпечують ефективну санацію ураженої ділянки, знижують ризик поширення інфекції та підтримують загоєння кістки.
Основні хірургічні методи при остеомієліті:
- Санація та секвестректомія: Операція з видалення некротизованої, інфікованої кістки та навколишніх тканин для зниження бактеріального навантаження. Цей етап є критичним при хронічному остеомієліті та випадках з секвестрами (мертвими фрагментами кістки), оскільки інфіковані тканини є резервуарами для регенерації бактерій.
- Клінічний аспект: Широка санація може створити дефект у кістці, що вимагає реконструктивних процедур або кісткової пластики для забезпечення стабільності.
- Антисептична іригація рани: Іригація виконується внутрішньоопераційно з антисептиками, такими як повідон-йод або хлоргексидин, що знижує бактеріальну контамінацію та допомагає запобігти подальшому поширенню інфекції.
- Протокол іригації: Використовуйте підігрітий фізіологічний розчин із наступним застосуванням антисептичного розчину, переважно із застосуванням пульсуючої іригації для видалення біоплівки та зменшення бактеріального навантаження на поверхнях кістки.
- Використання антибіотик-імпрегнованих кульок: Для локальної доставки високих доз антибіотиків у вогнище інфекції використовують кульки, просочені антибіотиками (наприклад, гентаміцином або ванкоміцином).
Ці кульки випускають антибіотик безпосередньо в місце інфекції, забезпечуючи високу локальну концентрацію препарату без значних системних побічних ефектів.
- Клінічні докази: Дослідження показують покращений контроль інфекції при застосуванні антибіотик-імпрегнованих кульок як додаткової терапії до системної антибіотикотерапії, особливо при складних або резистентних до лікування інфекціях.
- Стабілізація кістки: Може знадобитися зовнішня фіксація або установка внутрішніх фіксаторів для забезпечення стабільності, особливо при значній втраті кісткової тканини. У випадках відсутності консолідації застосовується кісткова пластика або остеоіндуктивні агенти, такі як демінералізована кісткова матриця, для стимуляції загоєння.
- Практика на основі доказів: Зовнішня фіксація переважає у випадках інфікованих ділянок, оскільки вона знижує ризик інфікування імплантатів та може бути налаштована за потреби під час спостереження.
- Інтраопераційні посіви та тестування на чутливість: Під час санації зразки тканин повинні бути взяті для посіву та тестування на чутливість, щоб скоригувати антибіотикотерапію. Зразки з фістульних ходів або прямих ран забезпечують цінну інформацію для виявлення мультирезистентних збудників, що гарантує коректну антибіотикотерапію післяопераційно.
3. Додаткові методи лікування
Додаткові методи грають важливу роль у лікуванні остеомієліту, особливо у випадках хронічної інфекції або пацієнтів з ослабленою імунною відповіддю. Ці методи підтримують антибіотикотерапію та хірургічне втручання, забезпечуючи додаткові способи контролю інфекції та покращуючи процес загоєння.
- Гіпербарична оксигенотерапія (ГБОТ): ГБОТ може бути корисною для пацієнтів з хронічним остеомієлітом, особливо у випадках поганої васкуляризації або інфекцій, резистентних до стандартної терапії. ГБОТ підвищує доставку кисню до інфікованої кістки, покращуючи функцію імунних клітин та сприяючи синтезу колагену і ангіогенезу.
- Протокол: ГБОТ зазвичай включає щоденні сеанси тривалістю 90-120 хвилин протягом кількох тижнів. Докази свідчать про покращення результатів у хронічних випадках остеомієліту при використанні ГБОТ поряд з антибіотиками та хірургічною санацією.
- Підтримка харчування: Правильне харчування, особливо білкова підтримка, важливі для загоєння ран та імунної функції. Недоїдання є відомим фактором ризику поганих результатів при остеомієліті, і пацієнтам слід надавати дієтичні рекомендації, адаптовані до їхніх потреб.
- Регулярний моніторинг та спостереження: Постійний моніторинг є важливим для оцінки відповіді на лікування та виявлення рецидиву інфекції. Регулярні візуальні та лабораторні дослідження, такі як щотижневий контроль рівня СРБ та ШОЕ, є рекомендованими для відстеження прогресу.
- СРБ та ШОЕ: Зниження СРБ на 50% після першого тижня лікування часто є сприятливим показником, тоді як динаміка ШОЕ допомагає оцінити довготривалу відповідь на терапію.
- Візуалізація: Повторна МРТ рекомендується при недостатній клінічній відповіді або у випадках хронічної інфекції для підтвердження ліквідації інфекції.
Детальний приклад лікувальної схеми для дорослого пацієнта з хронічним остеомієлітом MRSA-позитивним:
1. День 1: Початок емпіричної терапії в/в ванкоміцином в дозі 15-20 мг/кг кожні 8-12 годин з моніторингом рівнів препарату.
2. День 2-5: Хірургічна санація з інтраопераційним взяттям посівів, іригацією рани повідон-йодом, розміщенням антибіотик-імпрегнованих кульок та зовнішньою фіксацією для стабільності.
3. Тиждень 1: Переоцінка СРБ та ШОЕ; корекція дози ванкоміцину на основі результатів моніторингу.
4. Тиждень 2: Оцінка результатів посіву та корекція антибіотиків за необхідності; розгляд додавання перорального лінезоліду при переході на пероральну терапію.
5. Тиждень 2-6: Продовження в/в терапії ванкоміцином; щотижневий моніторинг СРБ/ШОЕ та корекція терапії відповідно до клінічних та лабораторних результатів.
6. Тиждень 6: Перехід на пероральний лінезолід при контрольованій інфекції та клінічній стабілізації пацієнта.
7. Плановий моніторинг: Щомісячні дослідження зображень та лабораторні тести протягом шести місяців після лікування, з МРТ при рецидиві симптомів.
Лікування остеомієліту у дітей
Дитячий остеомієліт, що часто проявляється у вигляді гострого гематогенного остеомієліту, в основному уражає довгі кістки, такі як стегнова, великогомілкова та плечова. Завдяки унікальним характеристикам скелету дітей, важливим є своєчасне та ефективне лікування, щоб запобігти порушенням росту, деформаціям суглобів та іншим довготривалим ускладненням. Лікування остеомієліту у дітей базується на таргетній антимікробній терапії, ретельному моніторингу, а в окремих випадках - хірургічному втручанні. Доказові протоколи наголошують на ранньому та агресивному лікуванні для досягнення оптимальних результатів.
1. Емпірична та таргетна антибіотикотерапія
Негайне початок внутрішньовенної (в/в) антибіотикотерапії є важливим у випадках підозри на дитячий остеомієліт, особливо у дітей з системними проявами інфекції, такими як лихоманка, дратівливість або обмежене використання ураженої кінцівки. Емпіричні антибіотики обираються відповідно до найімовірніших збудників, з корекцією лікування на основі результатів посіву та чутливості. Тривалість терапії зазвичай коротша, ніж у дорослих, однак ретельний моніторинг залишається критично важливим для оцінки відповіді на лікування та здійснення корекцій.
Основні режими антибіотикотерапії за віком і чутливістю збудника:
- Діти >5 років (імовірно метицилін-чутливий золотистий стафілокок [MSSA]):
- В/в флуклоксацилін: 50 мг/кг кожні 6 годин (максимум 2 г за дозу), обраний за високу ефективність проти MSSA та сприятливий профіль безпеки у дітей.
- Перехід на пероральний прийом: Після клінічного покращення переходять на пероральний флуклоксацилін 25-50 мг/кг кожні 6 годин. Дозу слід коригувати залежно від маси тіла та тяжкості інфекції.
- Тривалість: Зазвичай 3-4 тижні загалом, з щонайменше 1-2 тижнями в/в терапії, а потім переходять на пероральну терапію до повного одужання.
- Діти <5 років (ризик Kingella kingae):
- В/в цефазолін: 50 мг/кг кожні 8 годин (максимум 2 г за дозу). Цефазолін обирають за його ефективність проти Kingella kingae, поширеного збудника у молодших дітей, особливо при гематогенному остеомієліті.
- Перехід на пероральний прийом: Перехід на пероральний цефалексин 30 мг/кг кожні 8 годин після покращення.
- Тривалість: 3-4 тижні, залежно від відповіді на лікування, з щонайменше 7-10 днями в/в терапії.
- MRSA (метицилін-резистентний золотистий стафілокок):
- В/в ванкоміцин: 15 мг/кг кожні 6 годин (максимум 750 мг за дозу) з терапевтичним моніторингом рівня препарату, щоб підтримувати оптимальні значення 15-20 мг/л, що є критично важливим для ефективності та мінімізації токсичності.
- Перехід на пероральний прийом: Пероральний кліндаміцин 10 мг/кг кожні 6 годин. Кліндаміцин забезпечує ефективне покриття MRSA та має добру проникність у кісткову тканину.
- Тривалість: Зазвичай 4-6 тижнів, з подовженням у випадках великої площі ураження або повільної відповіді на лікування.
Додаткові зауваги щодо антибіотикотерапії у дітей:
1. Терапевтичний моніторинг рівнів препарату (TDM): TDM є важливим для ванкоміцину, особливо у молодших дітей, для уникнення нефротоксичності та забезпечення терапевтичних рівнів.
2. Додаткова терапія: Якщо пацієнт не реагує на першу лінію терапії, розгляньте додаткову терапію з лінезолідом або даптоміцином, особливо у випадках резистентних збудників. Лінезолід є корисним через його чудову біодоступність та проникність у кісткову тканину, хоча тривале застосування слід обмежувати для уникнення гематологічних побічних ефектів.
2. Хірургічне лікування
Хоча антибіотикотерапія є основою лікування остеомієліту у дітей, у разі недостатньої відповіді на антибіотики, прояви, такі як стійкі симптоми, підвищення маркерів запалення або візуалізаційні дані про абсцес або некротичну тканину, можуть вимагати хірургічного втручання.
Основні хірургічні втручання при дитячому остеомієліті:
- Дренаж абсцесу та санація: Для дітей з візуалізаційними ознаками утворення абсцесу або некротичної кісткової тканини необхідне раннє хірургічне дренування або санація. Дренаж зменшує бактеріальне навантаження, знижує тиск і підвищує ефективність системних антибіотиків. У випадках, коли виявлено численні абсцеси, аспірація голкою під контролем ультразвуку або МРТ може надати цільове втручання без необхідності значного розтину.
- Кюретаж кістки: Якщо присутні секвестри (мертві фрагменти кістки), кюретаж дозволяє видалити інфіковану та некротизовану тканину, знижуючи бактеріальне навантаження та сприяючи загоєнню. Особливо важливо уникати ушкодження зони росту у дітей, оскільки це може призвести до довготривалих деформацій скелета.
- Промивання рани: Під час операції застосовують промивання фізіологічним розчином, повідон-йодом або іншими антисептичними розчинами для зниження місцевого бактеріального навантаження і запобігання поширенню інфекції. У випадках великого ураження може знадобитися повторне промивання за допомогою пульсуючої подачі для руйнування біоплівок та зменшення колонізації бактеріями.
- Забір матеріалу для посіву та тестування чутливості: Під час хірургічного втручання важливо взяти зразки тканини або мазки для посіву та тестування чутливості. Ці зразки допомагають коригувати антибіотикотерапію, особливо у випадках хронічної або рецидивуючої інфекції, шляхом визначення резистентних збудників та забезпечення цілеспрямованого й ефективного лікування.
3. Додаткова та підтримуюча терапія
Додаткові терапії відіграють підтримуючу роль у лікуванні остеомієліту у дітей, особливо у хронічних або рецидивуючих випадках, коли традиційне лікування може бути недостатнім. Вони сприяють загоєнню, підвищують ефективність антибіотиків і підтримують загальне одужання.
- Іммобілізація ураженої кінцівки: Іммобілізація за допомогою шин або ортезів може бути рекомендована на початковому етапі лікування для зниження болю, мінімізації рухливості та запобігання поширенню інфекції. Іммобілізація також сприяє дотриманню режиму спокою, що є важливим для одужання у дітей.
- Харчова підтримка: Добре збалансоване харчування важливе для оптимальної функції імунної системи та загоєння кісток. Діти з остеомієлітом можуть потребувати підвищеного споживання білка для підтримки загоєння, а також адекватної кількості вітамінів і мінералів, таких як вітамін D і кальцій, необхідних для здоров'я кісток.
- Регулярний моніторинг та спостереження: Контроль маркерів запалення, таких як C-реактивний білок (CRP) і швидкість осідання еритроцитів (ШОЕ), є важливим протягом усього лікування для оцінки відповіді на лікування. Діти повинні проходити щотижневі обстеження протягом активної фази лікування і щомісячні наступні обстеження, доки інфекція не буде підтверджена як ліквідована.
- Динаміка CRP та ШОЕ: Зниження CRP щонайменше на 50% протягом першого тижня є сприятливим показником ефективності лікування. ШОЕ, хоча і повільніше реагує, може слугувати довготривалим індикатором активності інфекції.
- Подальша візуалізація: МРТ рекомендується у випадках поганої клінічної відповіді або підозри на залишкову інфекцію. Повторна візуалізація допомагає виявити стійке ураження кістки, забезпечуючи раннє втручання, якщо необхідно.
- Гіпербарична оксигенотерапія (ГБО): У випадках хронічного або резистентного до лікування остеомієліту ГБО може бути корисною. Підвищення оксигенації підтримує функцію імунної системи, підвищує активність антибіотиків і сприяє загоєнню. Дослідження підтверджують її використання при резистентному остеомієліті, особливо у дітей зі зниженою кровопостачанням ураженої ділянки.
Приклад детальної схеми лікування дитячого остеомієліту (гематогенний, MSSA позитивний):
1. День 1-7: Почати в/в флуклоксацилін 50 мг/кг кожні 6 годин на основі підозри на MSSA. Провести посів крові та тканини.
2. День 2-5: Оцінити клінічну відповідь шляхом щоденної оцінки симптомів, використання кінцівки та рівня болю. Моніторити рівні CRP та ШОЕ.
3. День 7: Оцінити результати посіву для підтвердження MSSA. При необхідності коригувати антибіотики на основі чутливості. Перейти на пероральний флуклоксацилін, якщо стан стабільний і симптоми покращуються.
4. Тижні 2-4: Продовжувати пероральний флуклоксацилін 25-50 мг/кг кожні 6 годин. Оцінювати щотижнево CRP та ШОЕ; перевіряти наявність симптомів, таких як лихоманка, біль у кінцівці або обмежене використання.
5. Подальша візуалізація: МРТ або УЗД може бути повторене, якщо симптоми зберігаються або маркери запалення залишаються підвищеними понад 4 тижні.
6. Завершення терапії: Припинити антибіотики, якщо дитина залишається безсимптомною та CRP і ШОЕ нормалізовані.
Моніторинг та подальші обстеження
Ефективне лікування остеомієліту потребує ретельного моніторингу для оцінки відповіді на лікування, підтвердження ліквідації інфекції та запобігання рецидиву. Дітям, особливо при залученні зон росту, необхідний регулярний моніторинг через ризик виникнення порушень росту або деформацій скелету.
Моніторинг C-реактивного білка (CRP) та швидкості осідання еритроцитів (ШОЕ):
CRP і ШОЕ є важливими маркерами запалення та інфекції. У випадку гострого остеомієліту ці маркери часто підвищуються і знижуються в міру ліквідації інфекції. Зниження CRP на 50% і більше протягом першого тижня лікування є сприятливим показником ефективності лікування. ШОЕ змінюється повільніше, що дозволяє оцінювати довготривалу активність інфекції, особливо у хронічних або рецидивуючих випадках.
Подальша візуалізація:
МРТ є переважним методом для оцінки відповіді на лікування та виявлення залишкової або рецидивуючої інфекції, особливо при хронічному остеомієліті чи недостатньому клінічному покращенні. Повторне МРТ можна призначити на ключових етапах лікування або після завершення антибіотикотерапії для підтвердження ліквідації інфекції та запобігання рецидиву.
Довгостроковий моніторинг для дітей:
Оскільки остеомієліт у дітей може залучати зони росту, що підвищує ризик порушення росту та деформацій, таким пацієнтам необхідний моніторинг аж до досягнення ними зрілості скелету. Регулярні клінічні обстеження та візуалізація дозволяють вчасно виявляти можливі порушення росту або деформації і забезпечувати своєчасне ортопедичне втручання при необхідності. Моніторинг включає оцінку довжини кінцівок, вирівнювання суглобів і функціональності протягом усього періоду росту.
Планові наступні візити:
- 1 тиждень після початку лікування: Перевірка рівнів CRP, ШОЕ та клінічних симптомів. Оцінка необхідності коригування лікування на основі ранньої відповіді.
- Після завершення внутрішньовенного етапу терапії: Підтвердження клінічного покращення перед переходом на пероральні антибіотики.
- Через 1 місяць після завершення терапії: Повторна оцінка рівнів CRP, ШОЕ та залишкових симптомів; призначення МРТ при необхідності.
- 3-6 місяців після лікування: У хронічних випадках або за залучення зон росту, необхідні повторні візуалізаційні дослідження та клінічна оцінка. Для пацієнтів дитячого віку з залученням зон росту рекомендуються тривалі наступні обстеження кожні 6-12 місяців до завершення росту.
Висновок
Лікування остеомієліту вимагає добре скоординованого, міждисциплінарного підходу, який включає співпрацю між ортопедами, інфекціоністами, радіологами і, при необхідності, педіатрами чи реабілітологами. Основними компонентами успішного лікування є своєчасна та точна діагностика, швидкий початок антибактеріальної терапії, спрямованої на збудника, а також при необхідності хірургічне видалення некротичної тканини для запобігання поширенню інфекції.
Реалізація протоколів, заснованих на доказовій медицині, і ретельний моніторинг стану пацієнта є основними умовами досягнення оптимальних результатів лікування. Регулярне спостереження за перебігом захворювання через клінічні оцінки, лабораторні маркери та візуалізаційні методи дозволяє знизити ризик хронічного інфекційного процесу, мінімізувати ускладнення та своєчасно реагувати на можливі рецидиви.
Для дітей необхідне подовжене спостереження до зрілості скелету, щоб своєчасно виявляти можливі порушення в зоні росту та запобігати деформаціям. Завдяки ретельному та комплексному підходу до лікування остеомієліту дорослі та діти мають високі шанси на повне одужання та низький ризик рецидиву, що підкреслює важливість всеохоплюючого й міждисциплінарного підходу до терапії.
Джерела
Статтю підготував:
Василь М. Шлемко, лікар ортопед-травматолог